sekundäre Vermittler. Second-Messenger-Systeme Grundlegende Second-Messenger-Systeme Physiologie
Zweite Boten
Sekundäre Vermittler(Second Messenger, Second Messenger) sind Bestandteile des Signalübertragungssystems in der Zelle, kleine Signalmoleküle. Second Messenger sind Bestandteile von Signaltransduktionskaskaden, die schnell gebildet werden und dann Effektorproteine aktivieren, die die Antwort der Zelle vermitteln. Zu den häufigsten sekundären Botenstoffen gehören cAMP und andere zyklische Nukleotide, Calciumionen und Stickstoffmonoxid.
Die Konzentration von Second Messenger im Zytosol kann auf verschiedene Weise erhöht werden: durch Aktivierung der Enzyme, die sie synthetisieren, wie zum Beispiel im Fall der Aktivierung von Cyclasen, die zyklische Formen von Nukleotiden (cAMP, cGMP) bilden, oder durch Öffnung Ionenkanäle, die den Fluss von Metallionen ermöglichen, z. B. Kalziumionen, gelangen in die Zelle. Diese kleinen Moleküle können Effektormoleküle, Proteinkinasen, Ionenkanäle und eine Vielzahl anderer Proteine weiter binden und aktivieren.
Einstufung
Sekundäre Botenstoffe werden nach Wasserlöslichkeit und Molekülgröße klassifiziert.
- Hydrophobe Moleküle – wasserunlösliche Moleküle, zum Beispiel Diacylglycerol, Inosittriphosphat, Phosphatidylinositole – sind mit der Membran assoziiert und können in den Perimembranraum dissoziieren, wo sie die Aktivität von mit der Membran assoziierten Proteinen binden und regulieren;
- Hydrophile Moleküle – wasserlösliche Moleküle, zum Beispiel cAMP, cGMP, Ca 2+ – befinden sich im Zytosol;
- Gase - Stickoxid (), Kohlenmonoxid () - können aus dem Zytosol durch Zellmembranen gelangen.
Wikimedia-Stiftung. 2010 .
Sehen Sie in anderen Wörterbüchern, was "Second Messenger" sind:
- (Secondary Messenger, englisch Second Messenger) sind kleine Signalmoleküle, Bestandteile des Signalübertragungssystems in der Zelle. Sekundäre Intermediäre sind Bestandteile von Signalübertragungskaskaden, sie bilden sich schnell und aktivieren dann ... ... Wikipedia
Sekundäre Botenstoffe (Second Messenger, Second Messenger) sind Bestandteile des Signalübertragungssystems in der Zelle, kleine Signalmoleküle. Sekundäre Intermediäre sind Bestandteile von Signalübertragungskaskaden, die sich schnell bilden und weiter ... ... Wikipedia
Phospholipid Phospholipide sind komplexe Lipide, Ester von mehrwertigen Alkoholen und höheren Fettsäuren. Sie enthalten einen Phosphorsäurerest und eine zusätzliche Gruppe von Atomen verschiedener chemischer Natur, die damit verbunden sind ... Wikipedia
Synapsen, in denen die Erregungsübertragung durch Acetylcholin erfolgt. Inhalt 1 Biochemie 2 Arten von cholinergen Rezeptoren ... Wikipedia
Phospholipid Phospholipide sind komplexe Lipide, Ester von mehrwertigen Alkoholen und höheren Fettsäuren. Sie enthalten einen Phosphorsäurerest und eine damit verbundene zusätzliche Gruppe von Atomen unterschiedlicher chemischer Natur. Inhalt 1 Klassifikation ... ... Wikipedia
Phospholipide sind komplexe Lipide, Ester von mehrwertigen Alkoholen und höheren Fettsäuren. Sie enthalten einen Phosphorsäurerest und eine damit verbundene zusätzliche Gruppe von Atomen unterschiedlicher chemischer Natur. Inhalt 1 Klassifizierung von Phospholipiden ... Wikipedia
Auflistung- (Listing) Listing ist eine Reihe von Verfahren zur Zulassung von Wertpapieren zum Umlauf an der Börse Definition der Notierung, Vor- und Nachteile der Notierung, Arten der Notierung, Phasen des Notierungsverfahrens, Listung Notierungsliste, Delisting ... ... Enzyklopädie des Investors
Bücher
- Atlas der Physiologie. In 2 Bänden. Band 1. Studienführer, Andrey Glebovich Kamkin, Irina Sergeevna Kiseleva. Der Atlas ist ein Buch, in dessen Zeichnungen und Textteil nicht nur Vorstellungen über die Funktionen des Körpers gegeben werden, sondern auch die Mechanismen dieser Funktionen am Organ, Gewebe, Zelle, ...
- Atlas der Physiologie. In 2 Bänden. Band 2. Studienführer, Andrey Glebovich Kamkin, Irina Sergeevna Kiseleva. Der Atlas gibt nicht nur Aufschluss über die Funktionen des Körpers, sondern zeigt auch die Mechanismen dieser Funktionen auf Organ-, Gewebe-, Zell-, Membran- und molekularer Ebene anhand von ...
die Zelle wandelt eine Art von Signal oder Reiz in eine andere um.
1. Wechselwirkung eines äußeren Agens (Stimulus) mit einem Zellrezeptor,
2. Aktivierung des in der Membran befindlichen Effektormoleküls, das für die Generierung von Second Messenger verantwortlich ist,
3. Bildung von Second Messenger,
4. Aktivierung von Zielproteinen durch Botenstoffe, wodurch die folgenden Botenstoffe erzeugt werden,
5.Verschwinden von Instant Messengern.
Second Messenger sind intrazelluläre Substanzen, deren Konzentration durch Neurotransmitter-Hormone und andere extrazelluläre Signale streng kontrolliert wird – Primary Messenger (First Messenger).
Als Rezeptoragonist kann eine Zelle speziell synthetisierte Peptidverbindungen verwenden oder ihre intrazellulären Metaboliten verwenden, die in der extrazellulären Umgebung fehlen. Das extrazellulär wirkende Coenzym ATP und Glutamat sind starke Neurotransmitter. Natürliche extrazelluläre Liganden, die mit Rezeptoren interagieren und diese aktivieren, werden als primäre Botenstoffe bezeichnet. Sie können unterteilt werden in Hormone, Neurotransmitter, Zytokine, Lymphokine, Wachstumsfaktoren, lipophile Moleküle mit Rezeptoren, Chemoattraktoren usw. Jeder dieser Begriffe steht für eine Klasse von Agenten, die auf ziemlich spezifische Weise agieren. Es gibt jedoch Beispiele für die Multifunktionalität der primären Botenstoffe: ATP und Glutamat sind Neurotransmitter, wenn sie an Synapsen ausgeschüttet werden. Gastrointestinale Hormone wie Gastrin, Cholecytokinin und Sekretin erfüllen mehrere neuromodulatorische Funktionen im Zentralnervensystem, indem sie die Freisetzung anderer Neurotransmitter beeinflussen. Somatostatin, das ursprünglich als Sekretagog des hypothalamischen Wachstumshormons identifiziert wurde, fungiert auch als Neurotransmitter und Neuromodulator im Zentralnervensystem. Darüber hinaus ist es ein parakriner Wirkstoff für Pankreaszellen und ein Hormon für die Leber. Der Blutplättchen-Wachstumsfaktor TGFb wirkt auch als chemischer Lockstoff und als Wachstumshemmer. Thrombin ist ein Wachstumsfaktor, ist aber auch als Aktivator der Blutplättchenfunktion an der Blutgerinnung beteiligt.
Die Mechanismen, die externe Signale in intrazelluläre umwandeln, befinden sich in der Plasmamembran der Zelle. Die Wahrnehmung externer Signale durch Zellen erfolgt hauptsächlich aufgrund der Wechselwirkung externer Faktoren mit zellulären Rezeptoren, die sich auf der äußeren Membran von Zellen befinden. Rezeptoren erkennen und binden ein externes Signal (Signalstoff – Ligand) und aktivieren intrazelluläre Informationsübertragungswege, die zum Start und zur Regulierung verschiedener intrazellulärer Prozesse führen.
Der externe Signalstoff, Primärbotenstoff genannt, dringt in der Regel nicht in die Zelle ein, sondern interagiert gezielt mit Rezeptoren auf der äußeren Zellmembran. Als primäre Mediatoren wirken verschiedene chemische Verbindungen (Hormone, Neurotransmitter, Gastransmitter etc.) oder physikalische Faktoren (Lichtquanten). Es gibt jedoch hydrophobe Hormone (Steroid und Schilddrüse), die in der Lage sind, unter Überwindung der Lipiddoppelschicht in die Zelle einzudringen und dort mit löslichen Rezeptorproteinen zu interagieren. Kleine Moleküle NO und CO haben den gleichen Wirkungsmechanismus.
Wirkt ein externes Signalmolekül auf die Rezeptoren der Zellmembran und aktiviert diese, dann leiten diese die empfangene Information an das System der Eiweißbausteine der Membran weiter, die sogenannte Signaltransduktionskaskade. Membranproteine der Signaltransduktionskaskade werden unterteilt in:
Rezeptor-assoziierte Transducer-Proteine
Enhancer-Enzyme, die mit Transducer-Proteinen assoziiert sind (aktivieren sekundäre intrazelluläre Botenstoffe, die Informationen in die Zelle transportieren).
So wirken G-Protein-gekoppelte Rezeptoren. Andere Rezeptoren (Ionenkanäle, Rezeptoren mit Proteinkinase-Aktivität) dienen selbst als Multiplikatoren.
Der Zellzyklus und seine Perioden
Der Zellzyklus ist der Zeitraum des Bestehens einer Zelle vom Moment ihrer Entstehung durch Teilung der Mutterzelle bis zu ihrer eigenen Teilung.
Der Zellzyklus besteht also aus zwei Perioden:
1) eine Periode des Zellwachstums, die als "Interphase" bezeichnet wird, und
2) die Periode der Zellteilung, genannt „Phase M.“ In jeder Periode werden wiederum mehrere Phasen unterschieden
Typischerweise dauert die Interphase mindestens 90 % der Zeit des gesamten Zellzyklus. Beispielsweise treten in sich schnell teilenden Zellen höherer Eukaryoten aufeinanderfolgende Teilungen einmal alle 16–24 Stunden auf, und jede M-Phase dauert 1–2 Stunden. Die meisten Zellbestandteile werden während der gesamten Interphase synthetisiert, was es schwierig macht, einzelne Stadien darin zu isolieren.
In der Zwischenphase sind die G 1 -Phase, die S-Phase und die G 2 -Phase isoliert. Der Zeitraum der Interphase, in dem die DNA-Replikation des Zellkerns stattfindet, wurde als "S-Phase" bezeichnet. Der Zeitraum zwischen der M-Phase und dem Beginn der S-Phase wird als G 1 -Phase bezeichnet, und der Zeitraum zwischen dem Ende der die S-Phase und die anschließende M-Phase wird als G 2 -Phase bezeichnet.
Die Periode der Zellteilung (Phase M) umfasst zwei Stadien: Mitose (Teilung des Zellkerns) und Zytokinese (Teilung des Zytoplasmas). Die Mitose wiederum wird in fünf Stadien eingeteilt Die Beschreibung der Zellteilung basiert auf den Daten der Lichtmikroskopie in Kombination mit Mikroverfilmung und auf den Ergebnissen der Licht- und Elektronenmikroskopie von fixierten und gefärbten Zellen.
Second Messenger leiten Signale zwischen Proteinen weiter, die einen bestimmten Abstand voneinander haben.
CAMP und Ca2+ sind übliche Second Messenger.
Die Signalübertragung verwendet sowohl Proteine als auch kleine Moleküle, charakteristische Eigenschaften haben. Kleine Moleküle, die als intrazelluläres Signal oder Second Messenger fungieren, haben gegenüber Proteinen als Signalzwischenstufe eine Reihe von Vorteilen. Kleine Moleküle bilden sich schnell und zerfallen genauso schnell.
Weil sie synthetisiert schnell, sie können in hohen Konzentrationen wirken, sodass ihre Affinität zu Zielproteinen gering sein kann. Die geringe Affinität ermöglicht es kleinen Molekülen, sich sofort zu dissoziieren, sodass die Signalübertragung schnell unterbrochen werden kann, wenn freie Second-Messenger-Moleküle abgebaut oder inaktiviert werden.
Weil die Second-Messenger-Moleküle klein, können sie sich schnell in der Zelle ausbreiten, obwohl es in vielen Zellen Mechanismen gibt, die dies verhindern. Bei der Entwicklung einer schnellen Reaktion auf ein Signal, insbesondere im Zusammenhang mit der Überwindung einer Distanz, haben Second Messenger also eine Reihe von Vorteilen gegenüber Proteinen.
Sekundär Boten werden auch verwendet, wenn es notwendig ist, Signale an viele Zielproteine gleichzeitig zu adressieren. Diese Vorteile kompensieren oft ihren Mangel an katalytischer Aktivität und ihre Unfähigkeit, mehrere Moleküle gleichzeitig zu binden.
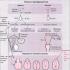
Die Abbildung unten zeigt intrazelluläre Second Messenger die während der Evolution in Zellen entstanden sind. Ihre Anzahl ist gering, was überraschend ist. Einige sind Nukleotide, die von wichtigen metabolischen Vorläufern abgeleitet sind. Dies sind cAMP, cGMP, ffGff und CycloADP-Ribose. Andere lösliche Second Messenger sind phosphorylierter Zucker, Inosit-1,4,5-Triphosphat (IP3) und das zweiwertige Ca2+-Ion sowie das freie Radikal Stickoxid (NO).
Zu sekundäre Boten Lipidnatur schließen Diacylglycerol und Phosphatidylinositol-3,4,5-triphosphat, Phosphatidylinositol-4,5-diphosphat, Sphingosin-1-phosphat und Phosphatidsäure ein.
Zu den ersten Signalmolekülen, die als Second Messenger bezeichnet werden, gehört cAMP. Diesen Namen erhielt er, weil cAMP in tierischen Zellen als zweites intrazelluläres Signal als Reaktion auf die Wirkung vieler extrazellulärer Hormone, also der ersten Botenstoffe auf dem Signalübertragungsweg, gebildet wird. cAMP ist an der Informationsübertragung an verschiedene regulatorische Proteine in Prokaryoten, Pilzen und Säugetierzellen beteiligt (sein Vorkommen in höheren Pflanzen ist noch nicht nachgewiesen).
Aktivität Adenylatcyclase, das Enzym, das cAMP aus ATP synthetisiert, wird je nach Organismus, in dem es wirkt, auf verschiedene Weise reguliert. Bei Tieren ist Adenylatcyclase ein integrales Plasmamembranprotein und seine vielfältigen Formen werden durch verschiedene Mittel aktiviert. In tierischen Zellen wird Adenylatcyclase normalerweise durch Gs aktiviert, das ursprünglich als Regulator der Enzymaktivität beschrieben wurde. Einige Pilzenzyme werden auch durch G-Proteine aktiviert. Bakterielle Cyclasen sind durch vielfältigere Systeme der Aktivitätsregulation gekennzeichnet.
Lager auf zwei Arten entfernt. Es kann die Zelle unter der Wirkung einer ATP-abhängigen Anionenpumpe verlassen, wird aber viel häufiger von Mitgliedern der zyklischen Nukleotid-Phosphodiesterase-Familie hydrolysiert. Dies ist eine große Gruppe von Proteinen, die selbst unter mehrfacher regulatorischer Kontrolle stehen.
Prototyp-Regler Lager bei Tieren ist eine cAMP-abhängige Proteinkinase vorhanden, aber kurz nach der Identifizierung dieses Enzyms wurde ein cAMP-regulierter Transkriptionsfaktor entdeckt, und andere Effektoren sind jetzt bekannt. Das cAMP-System bleibt der Prototyp des eukaryotischen Signalsystems. Dies drückt sich darin aus, dass seine Bestandteile fast alle bekannten Arten von Signalmolekülen repräsentieren und alle Arten ihrer Wechselwirkungen zeigen: Hormon, Rezeptor, G-Protein, Adenylatzyklase, Proteinkinase, Phosphodiesterase und Ausscheidungspumpe.
Proteinkinase Cinch, dessen Aktivität durch einen Second Messenger stimuliert wird, ist ein Tetramer, das aus zwei katalytischen (C) und zwei regulatorischen (R) Untereinheiten besteht. Die R-Untereinheit bindet über eine Substratbindungsstelle an die katalytische Untereinheit und somit wird C in einem inaktiven Zustand gehalten. Jede R-Untereinheit bindet zwei zyklische Nukleotidmoleküle, d. h. vier cAMP-Moleküle pro PKA-Holoenzym. Wenn die Bindungsstellen gefüllt sind, dissoziiert das Dimer der R-Untereinheit schnell und hinterlässt zwei hochaktive freie katalytische Untereinheiten.
Affinität von R zu C in Anwesenheit und Abwesenheit von cAMP, unterscheidet sich um einen Faktor von etwa 10.000. Die ausgeprägt kooperative Natur der cAMP-Bindung führt zu einem sehr steilen Anstieg der Aktivierungskurve und zu einer Schwelle, unterhalb der keine signifikante Aktivierung von PKA auftritt. Somit steigt die PKA-Aktivität in einem sehr engen Bereich von cAMP-Konzentrationen stark an. PKA wird auch durch Phosphorylierung der Aktivierungsschleife reguliert. Die Phosphorylierung erfolgt gleichzeitig mit der Translation und ist für den Zusammenbau des R2C2-Tetramers erforderlich.
Meist Cinch sind zytosolische Proteine und besetzen spezifische Plätze in der Zelle, indem sie an die Gerüststrukturen von Organellen (Proteine, die A-Kinase oder ACAR fixieren) binden. Diese AKARs fördern die Phosphorylierung von Membranproteinen, einschließlich GPCRs, Transportern und Ionenkanälen. Sie sorgen auch für die Lokalisierung von PKA an anderen Orten: in Mitochondrien, Zytoskelett und Zentrosomen. AKAPs enthalten häufig Bindungsstellen für regulatorische Moleküle wie Phosphoproteinphosphatasen und andere Proteinkinasen, die für die Koordination der Funktion mehrerer Signalwege und die Integration von Ausgangssignalen unerlässlich sind.
Normalerweise Cinch phosphorylieren Substrate unter Beteiligung der Sequenz Arg-Arg-Xaa-Ser-hydrophober Rest, die in einer großen Gruppe von Kinasen basische Aminosäurereste erkennt, die sich vor der Phosphorylierungsstelle befinden. PKA ist an der Regulierung der Aktivität verschiedener intrazellulärer Proteine beteiligt, von Ionenkanälen bis hin zu Transkriptionsfaktoren, und aufgrund der Substratspezifität eines Enzyms ist es oft möglich, basierend auf der Analyse vorherzusagen, ob es sich um ein Substrat für eine Kinase handelt die Primärstruktur eines Proteins.
Cinch phosphoryliert Ser 133 in CREB, ein Protein, das an das cAMP-abhängige Element bindet, das hauptsächlich den Einfluss von cAMP auf die Transkription vieler Gene liefert.
Wichtige intrazelluläre Second Messenger, einige Proteine,deren Tätigkeit sie regulieren, ihre Quellen und Funktionsweise.
 PKA ist ein Heterotetramer, das aus zwei katalytischen (C) und zwei regulatorischen (R) Untereinheiten besteht.
PKA ist ein Heterotetramer, das aus zwei katalytischen (C) und zwei regulatorischen (R) Untereinheiten besteht. Die Bindung von vier cAMP-Molekülen an die regulatorischen Untereinheiten führt zur Dissoziation von zwei C-Molekülen,
d.h. zur aktiven Form von PKA, die aus einem Dimer von mit cAMP assoziierten regulatorischen Untereinheiten gebildet wird.
Die untere Abbildung zeigt, dass die kooperative Bindung von vier cAMP-Molekülen zu einer abrupten Aktivierung der Kinase führt.
Bei einer nur 10-fachen Erhöhung der cAMP-Konzentration steigt die Aktivität der Kinase von 10 auf 90 %.
Das Auftreten der Schwelle wird durch kleine Aktivitätsänderungen bei niedrigen cAMP-Konzentrationen erklärt.
Bei der Signalübertragung in einer Zelle sind die primären Mediatoren chemische Verbindungen oder physikalische Faktoren (Lichtquanten), die den Mechanismus der Signalübertragung in der Zelle aktivieren können. In Bezug auf die Empfängerzelle sind primäre Botenstoffe extrazelluläre Signale. Es sollte beachtet werden, dass Moleküle, die in der Zelle reichlich vorhanden sind, aber normalerweise in sehr geringen Konzentrationen im Interzellularraum vorhanden sind (z. B. ATPyglutamat), auch als extrazelluläre Stimuli wirken können. Abhängig von den Funktionen können primäre Vermittler in mehrere Gruppen eingeteilt werden:
Zytokine
Neurotransmitter
Wachstumsfaktoren
Chemokine
Rezeptoren – spezielle Proteine, die der Zelle ein Signal der primären Botenstoffe liefern. Für diese Proteine sind die primären Botenstoffe Liganden.
Um die Rezeptorfunktion zu gewährleisten, müssen Proteinmoleküle eine Reihe von Anforderungen erfüllen:
Besitzen eine hohe Ligandenselektivität;
Die Kinetik der Ligandenbindung soll durch eine Kurve beschrieben werden, deren Sättigung dem Zustand der Vollbeschäftigung aller Rezeptormoleküle entspricht, deren Zahl auf der Membran begrenzt ist;
Rezeptoren müssen eine Gewebespezifität aufweisen, die das Vorhandensein oder Fehlen dieser Funktionen in den Zellen des Zielorgans widerspiegelt;
Die Bindung des Liganden und seine zelluläre (physiologische) Wirkung müssen reversibel sein, die Affinitätsparameter müssen den physiologischen Konzentrationen des Liganden entsprechen.
Zelluläre Rezeptoren werden in folgende Klassen eingeteilt:
Rezeptortyrosinkinasen
G-Protein-gekoppelte Rezeptoren
Ionenkanäle
Membran
zytoplasmatisch
Membranrezeptoren erkennen große (z. B. Insulin) oder hydrophile (z. B. Adrenalin) Signalmoleküle, die von sich aus nicht in die Zelle eindringen können. Kleine hydrophobe Signalmoleküle (z. B. Trijodthyronin, Steroidhormone, CO, NO) können durch Diffusion in die Zelle gelangen. Die Rezeptoren für solche Hormone sind normalerweise lösliche zytoplasmatische oder Kernproteine. Nachdem der Ligand an den Rezeptor bindet, werden Informationen über dieses Ereignis weiter entlang der Kette übertragen und führen zur Bildung einer primären und sekundären zellulären Antwort.
Rezeptoraktivierungsmechanismen. Wirkt ein externes Signalmolekül auf die Rezeptoren der Zellmembran und aktiviert diese, dann leiten diese die empfangene Information an das System der Eiweißbausteine der Membran weiter, die sogenannte Signaltransduktionskaskade. Membranproteine der Signaltransduktionskaskade werden unterteilt in:
Rezeptor-assoziierte Transducer-Proteine
Enhancer-Enzyme, die mit Transducer-Proteinen assoziiert sind (aktivieren sekundäre intrazelluläre Botenstoffe, die Informationen in die Zelle transportieren).
So wirken G-Protein-gekoppelte Rezeptoren. Andere Rezeptoren (Ionenkanäle, Rezeptoren mit Proteinkinase-Aktivität) dienen selbst als Multiplikatoren.
4.3.2. Sekundäre Vermittler
Dies sind niedermolekulare Substanzen, die durch die enzymatische Aktivität einer der Komponenten der Signaltransduktionskette gebildet oder freigesetzt werden und zu deren Weiterleitung und Verstärkung beitragen. Sekundäre Botenstoffe zeichnen sich durch folgende Eigenschaften aus: Sie haben ein geringes Molekulargewicht und diffundieren mit hoher Geschwindigkeit im Zytoplasma; werden schnell gespalten und schnell aus dem Cytoplasma entfernt. Zu den sekundären Vermittlern gehören:
Calciumionen (Ca2+);
zyklisches Adenosinmonophosphat (cAMP) und zyklisches Guanosinmonophosphat (cGMP)
Inosittriphosphat
lipophile Moleküle (z. B. Diacylglycerol);
Stickstoffmonoxid (NO) (dieses Molekül fungiert auch als primärer Botenstoff, der von außen in die Zelle eindringt).
Manchmal werden auch tertiäre Mediatoren in der Zelle gebildet. So wirken Ca2+-Ionen in der Regel als Second Messenger, aber bei der Signalübertragung mit Hilfe von Inosittriphosphat (Secondary Messenger) dienen die unter seiner Beteiligung aus EPR freigesetzten Ca2+-Ionen als tertiärer Mediator.
Signalübertragungsmechanismus geht von folgendem Schema aus:
Wechselwirkung eines externen Agens (Stimulus) mit einem Zellrezeptor,
Aktivierung eines in der Membran befindlichen Effektormoleküls, das für die Bildung von Second Messenger verantwortlich ist,
Die Bildung von sekundären Vermittlern,
Aktivierung von Zielproteinen durch Mediatoren, wodurch die Bildung der folgenden Mediatoren verursacht wird,
Das Verschwinden des Vermittlers.
Cell Signaling (Zellsignalisierung) ist Teil eines komplexen Kommunikationssystems, das grundlegende zelluläre Prozesse steuert und die Aktionen der Zelle koordiniert. Die Fähigkeit von Zellen, korrekt auf Veränderungen in ihrer Umgebung (Mikroumgebung) zu reagieren, ist die Grundlage für Entwicklung, Gewebereparatur, Immunität und das Aufrechterhaltungssystem der Homöostase als Ganzes. Fehler in zellulären Ikönnen zu Krebs, Autoimmunerkrankungen und Diabetes führen. Das Verständnis der Mechanismen der Signalübertragung innerhalb von Zellen könnte zur Entwicklung von Behandlungen für Krankheiten und sogar zur Schaffung von künstlichem Gewebe führen.
Traditionell konzentrierte sich die biologische Forschung auf die Untersuchung einzelner Teile des Signaltransduktionssystems. Die Kenntnis der Komponenten von Signalsystemen hilft, die Gesamtstruktur von Zellsignalsystemen zu verstehen und zu verstehen, wie Änderungen in ihnen die Übertragung und den Verlust von Informationen beeinflussen können. Signaltransduktionssysteme in einer Zelle sind komplex organisierte Komplexe und haben Eigenschaften wie Ultrasensitivität und Bistabilität (die Fähigkeit, in einem von zwei existierenden Zuständen zu sein). Die Analyse von Signaltransduktionssystemen in der Zelle beinhaltet eine Kombination aus experimentellen und theoretischen Studien, die die Entwicklung und Analyse von Modellen und Simulatoren beinhalten.
Zusammenfassung. In diesem Kapitel werden die wichtigsten Muster und Probleme der Molekularbiologie am Beispiel des Phänomens des programmierten Zelltods (Apoptose), interzellulärer und intrazellulärer Interaktionen, der Nutzung molekulargenetischer Marker (am Beispiel der Polymerase-Kettenreaktion) grundlegend und angewandt behandelt Zwecke.
Kontrollaufgaben
Ursprung und Evolution der Apoptose in verschiedenen Gruppen von Organismen.
Charakterisierung und Hauptwege der Induktion der Hauptphasen der Apoptose.
Grundlegende Mechanismen der Regulation der Apoptose.
Pathologien, die durch Verletzungen des Apoptoseprozesses verursacht werden.
Die Haupttypen molekulargenetischer Marker.
Entdeckungsgeschichte, Methode der Polymerase-Kettenreaktion.
Merkmale der Durchführung und Anwendung der wichtigsten PCR-Typen.
Bedeutung der Signaltransduktion bei interzellulären und intrazellulären Interaktionen.
Mechanismen der Aktivierung von Rezeptorproteinen.
Mechanismen der Signalübertragung während der interzellulären Interaktion.
Das Membranenzym Adenylatcyclase kann in zwei Formen vorliegen – aktiviert und inaktiviert. Die Aktivierung der Adenylatcyclase erfolgt unter dem Einfluss eines Hormon-Rezeptor-Komplexes, dessen Bildung zur Bindung des Guanylnukleotids (GTP) an ein spezifisches regulatorisch stimulierendes Protein (GS-Protein) führt, wonach das GS-Protein bewirkt die Anbindung von Mg an die Adenylatcyclase und ihre Aktivierung (Abb. 3.14).
Abb.3.14. Mechanismus der hormonellen Reizvermittlung durch das Adenylatcyclase-cAMP-System.
So wirken Adenylatcyclase-aktivierende Hormone - Glucagon, Thyrotropin, Parathyrin, Vasopressin (über V-2-Rezeptoren), Gonadotropin usw. Eine Reihe von Hormonen hingegen hemmt Adenylatcyclase - Somatostatin, Angiotensin-II usw. Hormon-Rezeptor-Komplexe dieser Hormone interagieren in der Zellmembran mit einem anderen regulatorischen inhibitorischen Protein (GI-Protein), was die Hydrolyse von GTP zu GDP und dementsprechend die Unterdrückung der Adenylatcyclase-Aktivität bewirkt. Adrenalin aktiviert die Adenylatcyclase durch beta-adrenerge Rezeptoren und unterdrückt sie durch alpha-1-adrenerge Rezeptoren.
Unter dem Einfluss der Adenylatcyclase wird cAMP aus ATP synthetisiert, was die Aktivierung von zwei Arten von Proteinkinasen im Zellzytoplasma bewirkt, was zur Phosphorylierung zahlreicher intrazellulärer Proteine führt. Dies verändert die Membrandurchlässigkeit, Aktivität und Menge an Enzymen, d.h. bewirkt hormontypische Stoffwechsel- und damit Funktionsverschiebungen. Tabelle 3.3 zeigt die Haupteffekte der Aktivierung von cAMP-abhängigen Proteinkinasen.
Neben der Aktivierung von Proteinkinasen werden die intrazellulären Wirkungen von cAMP auch durch drei weitere Mechanismen realisiert:
1) Calcium-Calmodulin-System,
2) Transmethylase-System,
3) Adenosin-5-monophosphat – Adenosin.
Die Rolle des Calcium-Calmodulin-Systems wird unten diskutiert. Das Transmethylase-System sorgt für die Methylierung von DNA, allen Arten von RNA, Chromatin und Membranproteinen, einer Reihe von Hormonen auf Gewebeebene und Membran-Phospholipiden. Dies trägt zur Umsetzung vieler hormoneller Einflüsse auf die Prozesse der Proliferation, Differenzierung, des Zustands der Membranpermeabilität und der Eigenschaften ihrer Ionenkanäle bei und beeinflusst, was besonders hervorzuheben ist, die Verfügbarkeit von Membranrezeptorproteinen für Hormonmoleküle.
Die Beendigung der hormonellen Wirkung, realisiert durch das Adenylatzyklase-cAMP-System, erfolgt mit Hilfe eines speziellen Enzyms cAMP-Phosphodiesterase, das die Hydrolyse dieses Second Messengers unter Bildung von Adenosin-5-Monophosphat bewirkt. Dieses Hydrolyseprodukt wird jedoch in der Zelle zu Adenosin umgewandelt, das eine deutliche Wirkung auf die Unterdrückung von Methylierungsprozessen hat, was auch bei der Umsetzung bestimmter hormoneller Einflüsse eine Rolle spielt.
2. Guanylatcyclase-cGMP-System
Guanylatcyclase-cGMP-System. Die Aktivierung der Membran-Guanylatcyclase erfolgt nicht unter direktem Einfluss des Hormon-Rezeptor-Komplexes, sondern indirekt durch ionisiertes Calcium und oxidative Systeme von Membranen. Auch die typische Stimulierung der Guanylatcyclase-Aktivität durch Acetylcholin erfolgt indirekt über Ca++. Durch die Aktivierung der Guanylatcyclase entfaltet auch das atriale natriuretische Hormon, ein Atriopeptid, die Wirkung. Durch Aktivierung der Peroxidation stimuliert die biologisch aktive Substanz (Gewebehormon) der Gefäßwand, ein entspannender Endothelfaktor, die Gu-Anylatzyklase. Unter dem Einfluss der Guanylatcyclase wird cGMP aus GTP synthetisiert, das cGMP-abhängige Proteinkinasen aktiviert, die die Phosphorylierungsrate der leichten Myosinketten in der glatten Muskulatur der Gefäßwände reduzieren und zu deren Entspannung führen. In den meisten Geweben sind die biochemischen und physiologischen Wirkungen von cAMP und cGMP entgegengesetzt. Beispiele sind die Stimulierung von Herzkontraktionen unter dem Einfluss von cAMP und ihre Hemmung durch cGMP, die Stimulierung der Kontraktion der glatten Darmmuskulatur durch cGMP und die Unterdrückung von cAMP. cGMP spielt eine Rolle bei der Hyperpolarisation retinaler Rezeptoren unter dem Einfluss von Lichtphotonen. Die enzymatische Hydrolyse von cGMP wird unter Verwendung einer spezifischen Phosphodiesterase durchgeführt.
3. System Phospholipase C - Inositoltriphosphat
Der Hormonrezeptorkomplex unter Beteiligung des regulatorischen G-Proteins führt zur Aktivierung des Membranenzyms Phospholipase C, das die Hydrolyse von Membranphospholipiden unter Bildung von zwei Second Messenger bewirkt: Inositol-3-Phosphat und Diadylglycerin. Inositol-3-Phosphat bewirkt die Freisetzung von Ca++ aus intrazellulären Depots, hauptsächlich aus dem endoplasmatischen Retikulum, ionisiertes Calcium bindet an ein spezialisiertes Protein Calmodulin, das für die Aktivierung einer Reihe von Proteinkinasen und die Phosphorylierung von intrazellulären Strukturproteinen und Enzymen sorgt ( Abb. 3.15).
Abb.3.15. Der Mechanismus der hormonellen Reizvermittlung durch das Phospholipase C - Inosit-3-Phosphat-System. Erläuterungen im Text.Diacylglycerin wiederum trägt zu einem starken Anstieg der Affinität von Proteinkinase C für ionisiertes Calcium bei, letzteres ohne Beteiligung von Calmodulin aktiviert es, was auch mit den Phosphorylierungsprozessen anderer Proteine endet. Diacylglycerol kann gleichzeitig eine andere Art der Hormonwirkung vermitteln, da es die Phospholipase A-2 aktiviert. Unter dem Einfluss des letzten Membranphospholipids wird Arachidonsäure gebildet, die eine Quelle starker metabolischer und physiologischer Wirkungen von Substanzen ist - Prostaglandine und Leukotriene. Es muss darauf hingewiesen werden, dass in verschiedenen Zellen die eine oder andere Art der Bildung von Second Messenger vorherrscht, die letztendlich die physiologische Wirkung des Hormons bestimmt. Durch die betrachteten Systeme sekundärer Mediatoren werden die Wirkungen von Adrenalin (in Verbindung mit dem alpha-adrenergen Rezeptor), Vasopressin (in Verbindung mit dem V-1-Rezeptor), Angiotensin II, Somatostatin, Oxytocin und anderen Hormonen realisiert.
4. Ca-Calmodulin-System
Ca-Calmodulin-System. Ionisiertes Calcium gelangt nach der Bildung eines Hormon-Rezeptor-Komplexes entweder aus der extrazellulären Umgebung aufgrund der Aktivierung langsamer Calciumkanäle der Membran (wie es beispielsweise im Myokard geschieht) oder aus intrazellulären Depots unter die Einfluss der oben beschriebenen intrazellulären Prozesse. Im Zytoplasma von Nicht-Muskelzellen bindet Calcium an ein spezielles Protein, Calmodulin, und in Muskelzellen übernimmt Troponin C die Rolle von Calmodulin.Calciumgebundenes Calmodulin ändert seine räumliche Organisation und aktiviert zahlreiche Proteinkinasen, die für die Proteinphosphorylierung sorgen. Außerdem aktiviert der Calcium-Calmodulin-Komplex die cAMP-Phosphodiesterase, die ihre Wirkung als Second Messenger unterdrückt. Eine kurzfristige Erhöhung des Kalziums in der Zelle und dessen Bindung an Calmodulin ist ein Startreiz für zahlreiche physiologische Prozesse – Muskelkontraktion, Ausschüttung von Hormonen und Freisetzung von Mediatoren, DNA-Synthese, Veränderungen der Zellmobilität, Transport von Stoffen durch Membranen, Veränderungen in der Enzymaktivität.